欧狄沃(O药)新患者援助方案:低“首付”门槛,剑指适应证内长生存获益
2020年国家医保目录调整结果公布后,119种谈判成功的品种包括了多种肿瘤创新药,其中国产PD-1悉数进入,外资PD-1/-L1则全部折戟。在国谈之后,O药和K药两家进口PD-1迅速推出了更新的患者援助方案,以应对市场竞争局面。
作为首个登陆中国的PD-1单抗,欧狄沃®(纳武利尤单抗注射液,俗称“O”药)率先推出新的患者援助方案,由原来的“首次3 3,后续3 4循环”调整为【年度“3 3,后续3 X”】。
新方案已于2021年1月1日起正式实施!这意味着,凡符合项目标准的患者首次自付3次,便可获3次援助。再次自付3次,即可获该申请年度内剩余的所有药品援助。
患者可按申请年度重复申请,直至项目终止或疾病进展。以60公斤患者为例,新方案下患者仅需首付5.5万元即可有机会尝试创新免疫肿瘤治疗,更多患者有望实现高质量的长期生存。

免疫治疗药物选择不能盲目,以适应证为基础才能兼顾疗效和经济性
目前国内已上市8种PD-1/L1单抗,究竟选择哪一种免疫药物,是很多患者关心的问题。
对于免疫药物的选择,应考虑该药物是否具有足够临床研究数据支持,并严格遵循治疗指南的推荐。
同时,患者如果希望享受药物援助政策,那就必须依据药物获批的适应证进行申请。
以O药为例,目前在国内获批了三大适应证——二线非小细胞肺癌[1]、含铂治疗进展头颈部鳞癌[2],以及经两次或以上全身治疗晚期胃/胃食管连接部癌[3],这也是此次患者援助项目所覆盖的适应证。
[1] 肺癌:用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
[2] 头颈鳞癌:单药用于接受含铂类方案治疗期间或之后出现疾病进展且肿瘤PD-L1表达阳性(表达PD-L1的肿瘤细胞≥1%) 的复发性或转移性头颈部鳞状细胞癌(SCCHN)患者。
[3] 胃癌:用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者。
免疫治疗获益数据各有千秋,最合适的才是最好的选择。
以肺癌为例,对于无驱动基因突变的患者,过往二线治疗以化疗为主,五年生存率不足5%。
自免疫肿瘤治疗进入中国以来,PD-1/L1抑制剂已成为肺癌二线治疗新标准。
一项以中国患者为主的III期临床研究CheckMate-078 随访数据显示,在二线获益于欧狄沃治疗的患者中,19%肺癌患者能够存活至少3年!1O药也成为唯一在《中国临床肿瘤学会(CSCO)肺癌诊疗指南》中获专家I级推荐用于晚期无驱动基因突变非小细胞肺癌(NSCLC)二线治疗的免疫检查点抑制剂(1A类证据)。
在中国,纳武利尤单抗仍是二线非小细胞肺癌中唯一获得III期研究阳性结果的肿瘤免疫治疗药物。
另一项同样以中国大陆患者为主的III期临床研究KEYNOTE-033结果显示,与多西他赛相比,虽然在数值上改善了OS,但在PD-L1 TPS≥50%的中国晚期NSCLC患者中未达到预先设定的统计学显著差异,研究未取得阳性结果。
在胃癌治疗中也有类似情况。一项名为ATTRACTION-2的Ⅲ期临床研究证实了胃癌免疫治疗在东亚人群中的有效性及安全性。
结果显示,与对照组相比,经两次或以上全身治疗的晚期胃癌患者一旦获益2于O药,其中有61.3%的患者生存期可延长至两年以上3。与对照组相比,欧狄沃使一年生存率翻倍,达27.3%4。
基于此,O药成为首个且目前唯一经III期临床研究证实能为中国经两次或以上全身治疗晚期胃癌患者带来显著生存获益的PD-1抑制剂,也是首个且目前唯一在中国获批用于胃/胃食管连接部癌治疗的免疫肿瘤药物。
另一项名为KEYNOTE-016研究结果显示,与化疗相比,帕博利珠单抗二线治疗并未显著改善PD-L1阳性胃癌/胃-食管交界处癌患者的OS和PFS。这使得O药成为目前在晚期胃癌后线治疗中唯一在III临床研究中获得阳性结果的肿瘤免疫治疗药物。
在《2020中国临床肿瘤学会(CSCO)胃癌诊疗指南》对于晚期转移性胃癌三线治疗的推荐中,欧狄沃成为唯一获推荐升级、唯一获专家I级推荐的PD-1抑制剂。
头颈鳞癌虽然发病率不是很高,但是50%的患者都会在2年内复发转移567,整体预后一般。
一项纳入中国头颈鳞癌患者人群Ⅲ期临床研究CheckMate-141结果显示,与标准治疗相比,欧狄沃降低死亡风险32%,16.9%的接受过化疗的患者使用欧狄沃生存期达两年,将患者两年生存率提高近3倍(标准治疗组6.0%);
同时,欧狄沃还可显著改善其生活质量。在欧狄沃治疗组中,患者总体健康状况维持或改善的时间延长至对照组的近2倍,中位时间达到5.4个月8。
基于此,欧狄沃成为中国首个获批用于头颈鳞癌治疗的PD-1单抗。
O药也是目前唯一在新版《中国临床肿瘤学会(CSCO)头颈肿瘤诊疗指南》中获专家I级推荐(1A类证据)的复发或转移性头颈部鳞癌二线治疗标准。
随着临床研究的不断深入,各家免疫抑制剂的数据层出不穷,进口PD-1们的研究数据都经历了时间的考验和真实世界的各种验证,相信以临床数据为基准的免疫治疗选择时代已经到来。
迄今为止,O药在66个国家和地区获批共11个瘤种,涵盖肺癌、头颈部鳞状细胞癌、胃癌、食管癌、肝癌、肾癌、结直肠癌、尿路上皮癌、黑色素瘤、霍奇金淋巴瘤、胸膜肿瘤,惠及的患者已近60万。
维持低“首付”门槛,让更多患者有机会尝试并获益!
作为首个且目前唯一获批用于二线非小细胞肺癌、含铂治疗进展头颈部鳞癌和经两次或以上全身治疗晚期胃癌的PD-1抑制剂,O药是唯一能够为以上三大适应证内患者提供患者援助的肿瘤免疫治疗药物。
新的患者援助方案有效减轻患者经济负担,提高药物可及性,让更多患者有机会获益于创新肿瘤免疫治疗。
由于免疫肿瘤药物具有起效徐缓稳健的特点,大部分的患者的明显获益会出现在接受治疗12周前后,期间产生的费用就是PD-(L)1治疗的门槛费用。
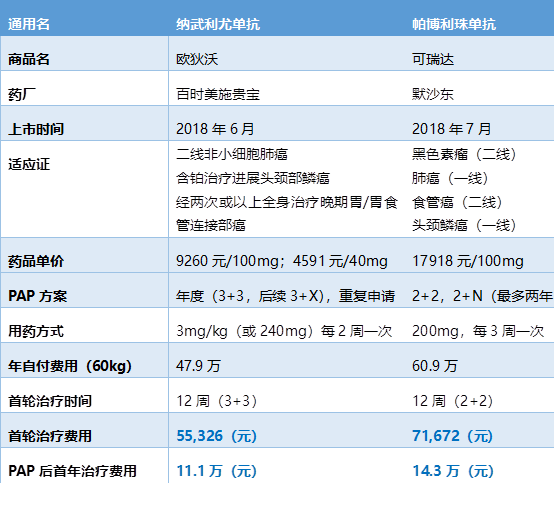
目前,在中国市场上O药建议零售价为9260元(100mg/10ml)、4591元(40mg/4ml),使用剂量为3mg/kg或240mg固定计量,经典用药方案为两周一次,如果按照60kg体重计算,用公斤体重方式患者每一个疗程需要1支100mg,2支40mg的药物。
新的援助方案中,O药的首付价格约5.5万元(3 3),年度治疗费用约11万元。与上市相比,首付经济门槛降低50%,年度治疗费用降幅超过75%。K药于近期同样推出新援助方案(“2 2”,“2 N”),首付费用约7.2万元(2 2),可获得4个疗程(12周)的援助,首年治疗费用约14万元。
O药新的援助方案中首轮的“3 3”大大减轻了患者初始治疗的经济压力,让每一个希望使用PD-1治疗的患者能以较低的自付费用尝试创新的肿瘤免疫治疗。
而在初始治疗结束后,后续的3 X方案可为患者的持续用药保驾护航,全年费用降低后,可以让尽可能多的肿瘤患者获得长期生存的机会。
无缝衔接,旧方案患者可实现顺畅过渡
相对新的援助方案,对于处于2020年的援助方案(3 3或3 4)申请或领药中的患者来说,目前推出了过渡方案,无缝衔接新的援助方案。
2021年1月1日(含当日)前已提交本周期申请但未批准领药的患者:
在完成当前援助周期(3 3或3 4)申请及领药后,可直接申请新方案的第二阶段(3 X)。当前援助周期患者第一次自购药的用药时间为新方案第一个申请年度的起点。
2021年1月1日(含当日)前已开始领药的患者:
在完成当前援助周期(3 3或3 4)领药后,可申请新方案的第二阶段(3 X)。当前援助周期患者第一次自购药的用药时间为新方案第一个申请年度的起点。
2021年1月1日(含当日)前已完成上周期领药但未提交下一周期申请的患者:
直接进入新方案的第二阶段申请(3 X)。最近一次3 3或3 4援助周期患者第一次自购药的用药时间为新方案第一申请年度的起点。
对于未连续用药的特殊情况患者,可致电项目热线400-669-0906详细咨询。

多措并举,提升药物可及性
患者援助项目的持续升级对患者而言无疑是好消息。然而不可否认的是,即便在援助项目的加持下,部分患者在治疗过程中仍面临着较大的经济压力。因此,构建多层次的医疗保障体系,探索创新支付模式是未来的新方向。近年来,各地政府通过推出地方附加补充医疗保险和商业健康保险等方式助力患者进一步提高创新药物可及性。
据悉,目前我国已有43个省市将欧狄沃纳入了地方附加补充医疗保险或商业健康保险项目,其中包括珠海、佛山、大连、桂林、南通、广州、徐州、德阳、苏州、衢州、绍兴、南京、惠州、无锡在内的14个城市允许患者带病参保并报销,未来还将进一步扩大。
以珠海为例,参保人员每年只要缴纳190元即可参加由当地政府主导的名为“大爱无疆”的附加补充医疗保险。带病参保的患者最终实际年自负费用有望降低到5万左右,健康参保的新发病患者预计年自负费用可低至2万以内。
相信在社会各界的共同努力下,好药不贵的梦想一定会实现!
相关资讯




































